Ecuacion Balanceada Del Agua
Ca H3BO3 CaBO3 H C8H11NO3 FeCl3 FeC8H7 HNO3 HCl C4H9NH2 HNO3 C4H9OH N2 H2O Ca NO32 NaCO3 Na NO3 Ca CO32 COOH22H2O KOH K2C2O4 H2O CH3Br Na C3H7Br NaBr C4H10 Ecuaciones recientemente balanceadas. H2O H 2 x 101 202 O 1 x 16 16 18-02 g 7.

Ejercicios De Balanceo De Ecuaciones Quimicas Por Oxido Reduccion Ecuaciones Experimentos De Quimica Quimicas
Balanceo tradicional 1 Anota la ecuación dada.

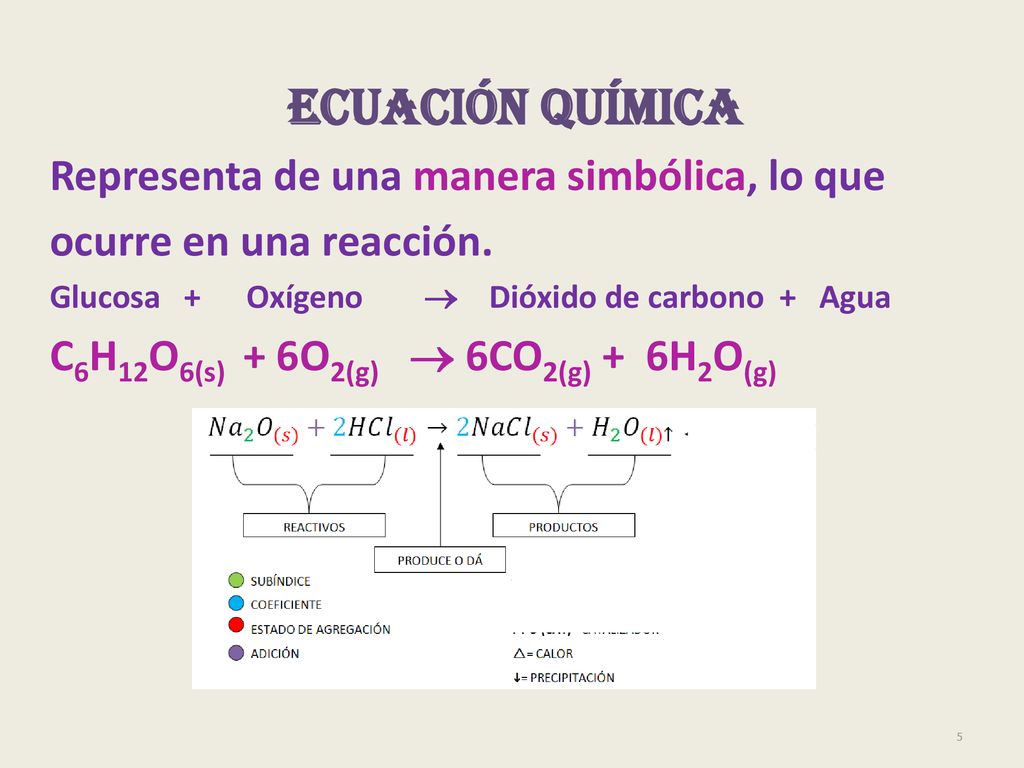
Ecuacion balanceada del agua. Como vemos la ecuación está balanceada. El balanceo de ecuaciones químicas es una operación matemática que se realiza para mantener la ley de la conservación de la materia en las reacciones. Un ácido formado por un sólo hidrógeno da lugar a un catión latexH.
Ahora se necesita conocer el número de moles de CO2 que hay en 205 gr de dicho compuesto para que así dada la ecuación calcular la cantidad de NaHCO3 necesario para producir los 205 gr de. CH 4 g 2 O 2 g CO 2 g 2 H 2O g reacción balanceada NOTA 1. H 2O agua 275 g Relación gramo-gramo PASO 3 Como la sustancia deseada no son moles calculamos el peso molecular para poder realizar la conversión de gramos a moles.
Para escribir una ecuación química de manera correcta hay que balancear. Esta reacción ocurre cuando el propano C 3 H 8 se quema en la presencia de oxígeno para producir agua y dióxido de carbono. Verificar el balanceo y en caso de encontrarse diferencias se realiza un pequeño tanteo.
La materia no se crea ni se destruye. Hay muchos factores a tomar en cuenta. Por consiguiente la ecuación balanceada se escribe así.
Hemos visto ya un par de ejemplos de cómo balancear ecuaciones y vimos que si tratamos de balancear esta ecuación deberíamos empezar con las moléculas más complicadas por ejemplo en el vídeo anterior vimos que si empezábamos con el carbono verdad aquí teníamos 2 carbonos mientras que del lado derecho teníamos sólo un carbono verdad teníamos 2 por el etileno mientras que del. Equilibra el número de átomos de hidrógeno multiplicando el número de moléculas de agua por 6 y el número de moléculas de hidróxido por 4. Mejor respuesta plis ゚ヮ゚.
Colocamos un tres porque ya hay tres átomos de oxígeno en la formula del Óxido Férrico. 4 ácido fosfórico son necesarios para producir 275 g de agua. 2H 2 O 2 2H 2 O.
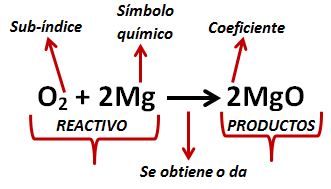
Esta ecuación química balanceada muestra que dos moléculas de hidrógeno se combinan o reaccionan con una molécula de oxígeno para formar dos moléculas de agua 2 moléculas de H 2 1 molécula de O 2 2 moléculas de H 2 O 2 H 2 O 2 2 H 2 O. La ecuación equilibrada para la descomposición de bicarbonato de sodio en carbonato de sodio dióxido de carbono y el agua es. Al escribir ecuaciones químicas el número delante del símbolo molecular llamado coeficiente indica el número de moléculas que participan en la reacción.
3NO₂ g H₂O l 2HNO₃ ac NO g Peso molecular H₂O 16 2 18 gmol. Debido a que la relación del número de moléculas es igual a la relación del número de moles la ecuación también puede leerse como 2. Para este ejemplo usarás.
Balancea las siguientes ecuaciones químicas. Cr2SO43 KOH KClO3 K2CrO4 H2OKCl K2SO4 Cr2SO43 KOH KClO3 K2CrO4 H2O KCl K2SO4. Esta ecuación química balanceadamuestra que dosmoléculas de hidrógeno se combinan o reaccionan con una molécula de oxígeno para formar dos moléculas de agua.
Luego tienes que multiplicar el número de moléculas de o 2 por 3 y el número. H 3PO 4 ácido fosfórico g Sustancia de partida. Si ningún coeficiente aparece delante de la molécula esto significa uno.
Para comprobar construimos la siguiente tabla. Principio Una fuente de alimentación eléctrica está conectada a dos electrodos o dos placas por lo general hechas de un metal inerte como el platino o acero inoxidable que se colocan en el agua. La electrólisis del agua es la descomposición de agua H 2 O en oxígeno O 2 y de hidrógeno gas H 2 debido a una corriente eléctrica que pasa a través del agua.
2 Anota el número de átomos por cada elemento que tengas a ambos lados de la ecuación. El óxido de magnesio MgO Forma hidróxido de magnesio en presencia de agua MgO H2O Mg OH2 pero puede ser revertida por calentamiento para separar la humedad. C 3 H 8 O 2 -- H 2 O CO 2.
2 Fe 2 6 O 6 6 H 6 Ejercicios. Peso molecular HNO₃ 1 14 3 16 63 gmol. Forma 4moléculas de agua Para completar el apartado se proponen las neutralizaciones de un ácido trivalente con los hidróxidos monovalentes bivalentes trivalentes y tetravalentes.
2 H 2 O H 3 O O H. A partir de 1 mol de agua y 3 moles de NO₂ se producen 2 moles de HNO₃. Para obtener la masa molecular multiplicamos el número de átomos de cada elemento por su masa atómica y las sumamos.
Oxígeno molecular para producir agua. Por lo tanto la ecuación para la descomposición del NaHCO3 es. Por un lado la fórmula empírica del agua es H 2 O sin embargo no es enteramente cierto que podamos tener un vaso de esa sustancia.
3H2SO 4 2Al OH 3 fl Al 2SO 43 6H2O 2H2SO 4 Pb OH 4fl Pb SO 42 4H2O. Está balanceada la siguiente ecuación. 2 NaHCO3 s Na2CO3 s CO2 g H2O g Como la mayoría de las reacciones químicas la velocidad de.
Por lo tanto el número de átomos antes y después de una reacción química debe ser el mismo tanto en los reactivos como en los productos. Este se puede expresar en los siguientes términos. Esto nos lleva a la primera conclusión.
2 y 2 en el agua. Es necesario realizar una conversión a moles. No es tan simple esta pregunta.
C7H8 l 9 O2 g 7 CO2 g 4 H2Ol. Lo primero que viene a mi mente es el equilibrio de autoionización del agua. 2 moléculas de H 2O con 1 átomo de O cada uno.
Contamos ahora los átomos de hidrógeno y observamos que hay seis átomos a ambos lados de la flecha por lo que la ecuación ha quedado balanceada. EJEMPLO Balancear por el método de oxido-reducción la siguiente ecuación siguiendo el método anterior. C6H12O6ac C2H5OH ac CO2g Mgs O2 g MgOs C3H8 g O2 g CO2 g H2Og 2.
De la ecuación química tenemos que. Cuando este ácido se disocia en agua el catión hidrógeno se separa del catión cloruro de la siguiente manera. Debemos entonces colocar un coeficiente estequiométrico delante de la molécula de oxígeno.
Para efectuarlo debemos calcular la masa molecular del agua. El hidrogeno del NaHCO3 forma un tercer producto agua dada la naturaleza de la reacción. En una ecuación balanceada el mismo número de átomos de oxígeno hidrógeno y hierro deben aparecer en ambos lados de la ecuación.
Recuerda que para balancear la ecuación química sólo debes agregar coeficientes estequiométricos.

Estequiometria Investiciencias Com Aprender Ingles Ingles

Clase 1 Balanceo Por Tanteo Balanceo De Ecuaciones Quimicas Ecuaciones Quimicas Nomenclatura Quimica

Quimica Paso A Paso Reacciones Acido Base Teoria Y Ejercicios Resueltos Ejercicios Resueltos Acidos Bases Teoria
Ecuacion Balanceada De La Electrolisis Del Agua
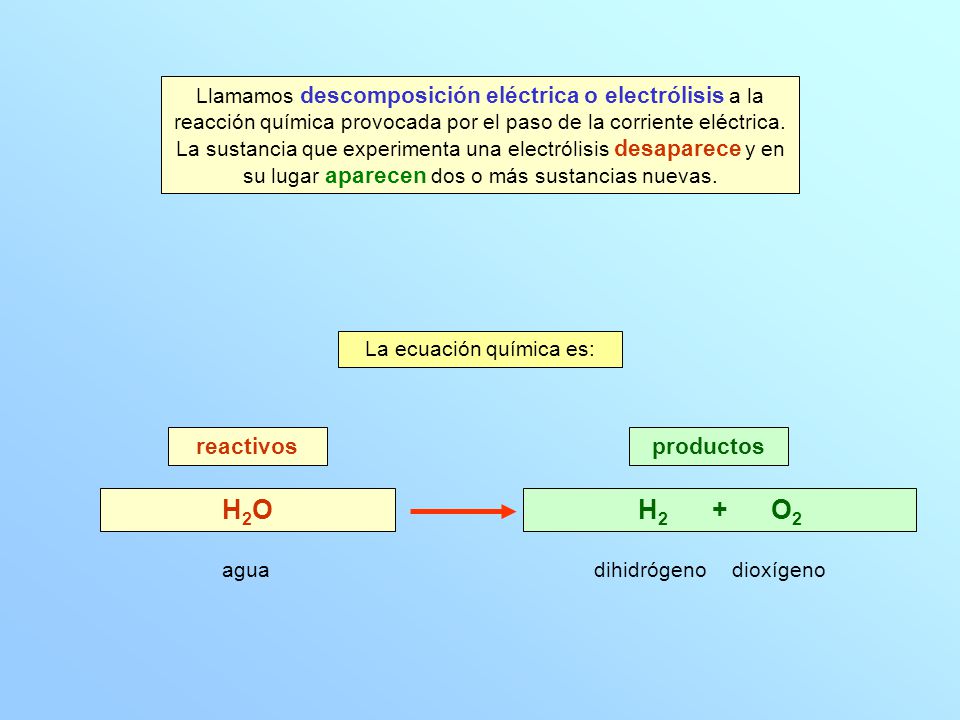
Electrolisis Del Agua Ecuacion

Actividades De Quimica Para Quinto Grado De Primaria Actividades 2021 En 2021 Reacciones Quimicas Quimicas Soluciones Quimicas

Como Saber Si Una Ecuacion Quimica Esta Balanceada Youtube

Quimica Paso A Paso Reacciones Acido Base Teoria Y Ejercicios Resueltos Ejercicios Resueltos Acidos Bases Teoria

H2o El Agua Liquida A Temperatura Ambiente Environmental Science Chemistry Cesar
Ecuacion Balanceada De La Electrolisis Del Agua

Como Balancear Ecuaciones Quimicas Chemical Equation Equations Molar Mass

Que Es Una Ecuacion Quimica Brainly

Reacciones Qumicas Evidencia De Reacciones Qumicas Cambio De
Balanceo De Ecuaciones Quimicas Spanish Ged 365
Cual Sera El Coeficiente Del Agua En La Ecuacion Ya Balanceada Pdf Mercurio Elemento Zinc

Ayuda Doy Corona La Ecuacion De Formacion De Agua A Partir De Hidrogeno Y Oxigeno Se Representa En La Brainly Lat

How To Balance Chemical Equations Ecuaciones Quimica Ensenanza De Quimica









Posting Komentar untuk "Ecuacion Balanceada Del Agua"